鸭脖赌注 | | 出处:公众号水生动物健康评估 作者:南湖意 vrbet888 2019-11-06 11:24:00 |
论文解读:Scientific Reports,鸭脖赌注。
今天小编给大家分享一篇文章,引用信息如下:

神经坏死病毒(NNV)是Nodaviridae病毒科,Betanodavirus病毒属的一种,可感染120多种鱼类,在世界范围内的水产养殖中造成高死亡率。目前已开发出多种NNV疫苗,其中许多可产生NNV中和抗体。近年来,已开发出有效的方法来诱导NNV感染后的鱼类恢复。有趣的是,在这些恢复期的鱼身上无法检测到NNV中和抗体,尽管这些鱼有很强的保护作用,不受NNV的再次感染。这表明,失活的NNV颗粒和自然的NNV颗粒在抗原性上可能存在一些细微的差异。
利用病毒样颗粒(VLPs)和反向遗传技术建立了NNV颗粒的晶体结构。NNV为无包膜球形,直径25-30 nm,由一个相对分子质量为42000的单外壳蛋白(CP)和两个阳性单链RNA分子组成。NNV-CP有三个主要结构域:N端臂(N-terminal arm)、壳结构域(S-domain)和突起结构域(P-domain)。三聚体P区在NNV颗粒表面形成60个突起。这些表面突起在病毒感染过程中的抗原性和受体相互作用中起着至关重要的作用。因此,产生NNV中和抗体的表位可以定位在这些突起上。根据抗NNV兔血清的中和试验,至少报告了三种不同的NNV血清型,根据RNA2可变区的核苷酸序列,NNV被分为四种基因型。
根据NNV基因型,病毒增殖的最适温度在15~30℃之间,最高温度在32~35℃之间。这些温度主要取决于编码RNA聚合酶的基因组RNA1,尽管编码CP的基因组RNA2也起着作用。NNV的感染性在37°c时逐渐下降,在≥60°c时急剧下降。这可能是由于NNV表面突起的变性,因为这些突起具有热敏性构象结构。用碳酸盐/碳酸氢盐缓冲液(PH 9.6)处理也容易使它们变性,这表明它们在某些条件下可能特别不稳定。在我们的初步实验中,我们观察到培养的NNV悬浮液在中低温下孵育后,尽管其抗原性保持不变,但感染性逐渐下降。
目前,NNV表面突起、CPs和粒子结构如何被热处理变性的细节尚不清楚。通过不同温度处理分析蛋白质结构和功能的变化是一种基本的生化方法。本研究通过研究适度的低温孵育后NNV感染性和抗原性的变化,分析NNV表面突起的稳定性和游离外壳蛋白(CP)的构象结构。培养的NNV悬液经45℃孵育后,其感染性逐渐下降,但抗原性保持不变;而纯化的NNV经45℃孵育后,感染性和抗原性均下降。热处理后NNV颗粒表面突起完全消失,但病毒颗粒结构保持不变。NNV感染性的降低似乎是由于病毒表面突起的热变性引起的。与无胎牛血清(FBS)存在条件下的病毒相比,胎牛血清(FBS)可延缓NNV感染性的丧失,表明FBS可作为NNV表面突起构象结构的稳定剂。此外,FBS的稳定功能随盐浓度的变化而变化。热处理后含游离CPs的培养的NNV悬浮液的抗原性可持续维持,表明,与NNV颗粒表面突起结构相比,游离CP突起结构具有更高的热稳定性。
主要研究结论如下:
1. 不同温度孵育下培养的NNV悬液的感染性和抗原性
培养的NNV悬浮液经过热处理,随后用去离子水DIW稀释320倍,然后用NNV抗原固定。培养的NNV悬液(109.3 TCID50/ml) 在25℃、7d内感染滴度稳定。然而,在40℃下孵育的NNV悬液在第7天的感染性逐渐下降到101.2 TCID50/ml,而在45℃、50℃和60℃下孵育的悬液在4、2和0.1天内的感染性分别下降到低于检测限值(≤100.8TCID50/ml)(图1A)。ELISA显示,在温度≤45℃(0.95±0.03)时,NNV抗原的酶联免疫吸附值稳定,而在50℃(0.95±0.03)下孵育的NNV抗原在第3天开始逐渐下降,第7天达到0.54。在60℃下孵育的ELISA值在0.1天内急剧下降到0.08(图1A)。
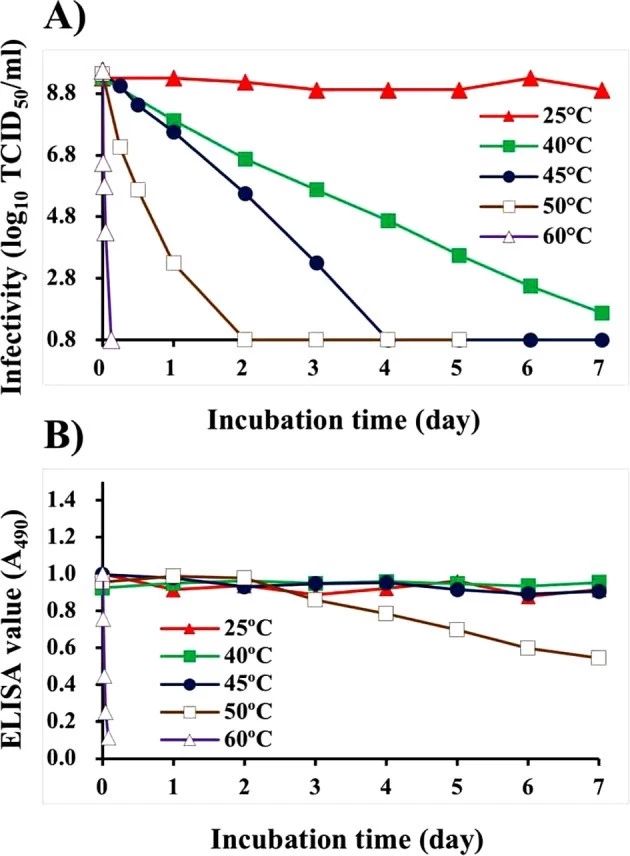
图1.不同赋予温度对NNV悬液感染性和抗原性的影响。
2. 25℃和45℃孵育下培养的NNV悬液(稀释320倍)的感染性和抗原性
用DIW、Tris-Hcl(15 mm,pH 8.0)或PBS将培养的NNV悬浮液预稀释320倍,并在25 C或45 C下培养7天(图2)。在45°C孵育后,分别在4、6或7天内,用DIW、Tris-Hcl(15 mm,pH 8.0)或PBS稀释的培养NNV悬液的感染性逐渐下降到低于检测限(≤100.8TCID50/ml)的水平(图2A1)。用L-1510培养基稀释培养液(A对照)的感染性在3天内也降至检测限以下。在45°C孵育后,用DIW(0.99±0.03)稀释的培养悬浮液在实验期间的酶联免疫吸附测定值几乎没有变化(图2A2)。而用Tris-Hcl(0.48±0.03)稀释的NNV悬液ELISA值几乎是DIW稀释的一半。用PBS稀释的NNV悬液在45°C下孵育2天后从0.41降至0.20。此后,未观察到酶联免疫吸附测定值的显著变化(0.22±0.02)(图2A2)。
在25℃下孵育后,不管稀释缓冲液的差异如何,培养悬浮液的感染性是稳定的(图2B1)。在整个实验过程中,用DIW稀释培养液的ELISA值稳定(0.92±0.05)。用Tris-Hcl和PBS(分别为0.44±0.03和0.36±0.02)稀释的ELISA值几乎是用DIW稀释的NNV悬液的一半。这些在实验期间是稳定的(图2B2)。
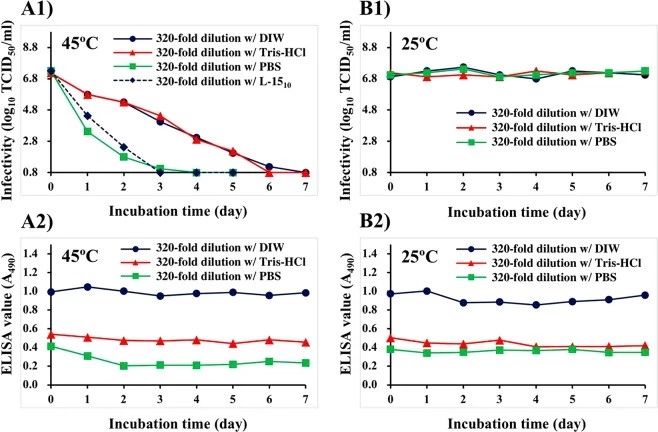
图2. DIW, Tris-Hcl, PBS稀释对培养NNV悬液感染性和抗原性的影响
3. 纯化的NNV颗粒在不同缓冲液中的感染性和抗原性
我们纯化了NNV颗粒,以观察在没有培养基成分的情况下,温度如何影响NNV的感染性和抗原性。在45°C下孵育后,不使用悬浮缓冲液的情况下,纯化的NNV颗粒的感染性在一天内降低到低于可检测限值,(图3A1)。纯化的NNV颗粒的ELISA值在半天内也降至≤0.07(图3A2)。
在25°C下孵育后,无论使用何种悬浮缓冲液,纯化的NNV颗粒的感染性和酶联免疫吸附测定值都是稳定的(图3B)。先前,我们已经证明,在4°C时,纯化的NNV颗粒在PBS中透析后,由于NNV颗粒的逐渐聚集,其抗原性降低。本研究证实,在4°C时,PBS中NNV颗粒的抗原性降低,但在25°C时不降低(数据未显示)。
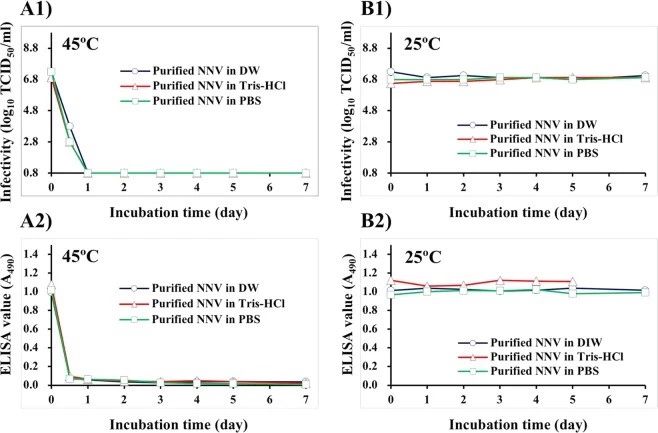
图3. 用DIW, Tris-Hcl, PBS稀释纯化的NNV颗粒对感染性和抗原性的影响
4. 用DIW、Tris-Hcl或PBS将纯化的NNV稀释320倍的影响
纯化后的NNV颗粒在l-1510培养基中,经DIW、Tris-Hcl(15 mm,PH8.0)或PBS稀释320倍后,在45°c孵育后,感染性逐渐下降,分别在5、4或3天内达到低于检测限的水平(图4A1)。分别从1.0到0.35或从0.6到0.15(图4A2),DIW或Tris稀释L-1510培养基中悬浮的纯化NNV颗粒的ELISA 测定值逐渐下降,而PBS稀释L-1510培养基中的NNV颗粒的ELISA 测定值在1天内从0.4下降到0.12(图4A2)。
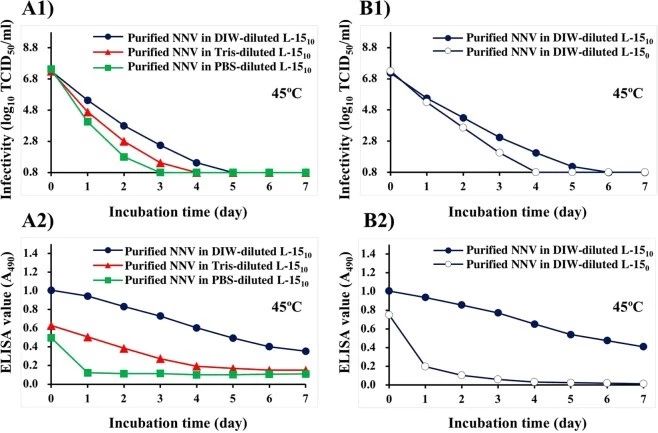
图4.用DIW, Tris-Hcl, PBS稀释320倍后,悬浮在L-1510或L-150中的纯化NNV颗粒的效果.悬浮在各缓冲液中的纯化NNV颗粒在45°C下孵育7天。
5. 从培养基中去除FBS的效果
DIW稀释L-1510培养基(无FBS)中纯化的NNV颗粒在45°C孵育后4天内感染性降至检测限以下,而DIW稀释L-1510培养基中纯化的NNV颗粒在2天内达到检测限以下(图4B1)。纯化的NNV颗粒在DIW稀释的l-1510培养基中的ELISA 值逐渐下降,在45℃孵育7天后达到0.41(图4B2)。在DIW稀释无FBS培养基中纯化的NNV颗粒在45°C孵育1天内从0.75下降到0.20,然后在6天以上孵育后逐渐下降到0.01(图4B2)。
6. 干燥固定对NNV抗原性的影响
无论培养温度如何,用Tris-Hcl或PBS稀释培养的NNV悬液的抗原性几乎减半(图2A2,B2)。为了研究盐浓度对NNV抗原性的影响,将NNV抗原悬浮在不同比例的Tris-Hcl与DIW或PBS与DIW的混合物中进行固定化。用Tris-Hcl(Tris-Hcl:DIW为10:0)或PBS(PBS:DIW为10:0)稀释培养的NNV悬液的ELISA值分别为0.49或0.42(图5A)。当Tri-Hcl或PBS的混合比降低(盐浓度降低)时,这些ELISA值增加到1。对于悬浮在Tris、PBS和DIW稀释L-1510介质混合物中的纯化NNV颗粒,观察到相同的结果(图5B)。Tris-或PBS稀释l-1510(Tris-Hcl:DIW或PBS:DIW,10:0)中NNV颗粒的ELISA值分别为0.41或0.43。当TrI Hcl或PBS的混合比降低(盐浓度降低)时,这些值增加到1。
相反,对于悬浮在TrI-Hcl、PBS或DIW中的纯化NNV颗粒,当悬浮缓冲剂的混合比例改变时,ELISA值没有显著变化(图5C)。结果表明,盐浓度对NNV颗粒的抗原性没有影响。然而,在含FBS的L-15稀释培养基中,无论在45°C下进行热处理,NNV颗粒和/或游离CPs的抗原性均随盐浓度的增加而下降。NNV抗原性下降可能是由于在干固定化过程中NNV抗原的聚集状态发生了改变,而不是由于热变性。FBS等培养基成分可能在改变NNV抗原的聚集倾向中起作用。
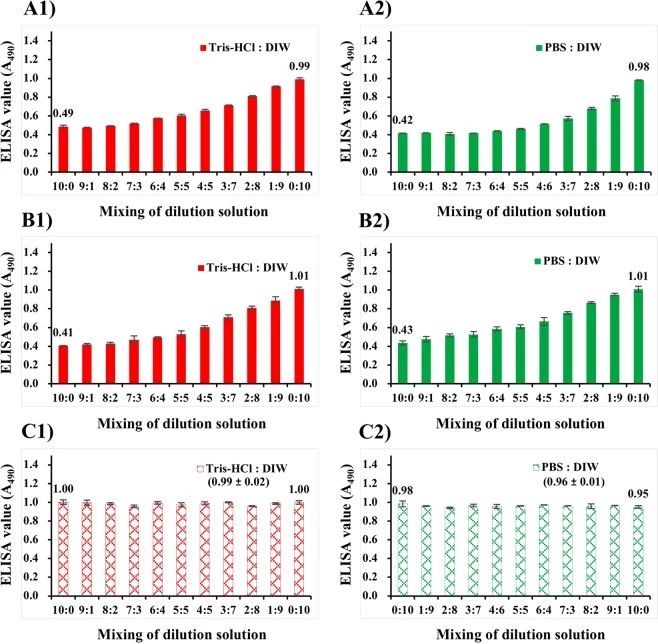
图5. 干燥固定对NNV抗原性的影响
7. 扫描电镜观察NNV颗粒表面突起
用FIB-SEM对45℃处理24小时或100℃处理5分钟的纯化NNV颗粒的表面结构进行了成像(图6)。未经热处理的对照样品显示直径约为30nm的NNV颗粒。此外,在这些表面上可以看到复杂的三维结构(图6A1-2)。然而,在45°C下孵育24小时(图6B,C)或100°C下孵育5分钟(图6D–F)后,表面形貌完全消失,而具有光滑表面(直径32–35 nm)的病毒颗粒状结构可靠地存在,与处理温度无关。以前有报道称,NNV颗粒表面突起对病毒抗原性和感染性起着至关重要的作用,并且这些表面突起对热变性敏感。因此,我们得出结论,我们观察到的NNV颗粒上的复杂三维结构是表面突起(图6A1,A2)。这些突出物显然对热变性非常敏感,而其余的颗粒结构则特别稳定。
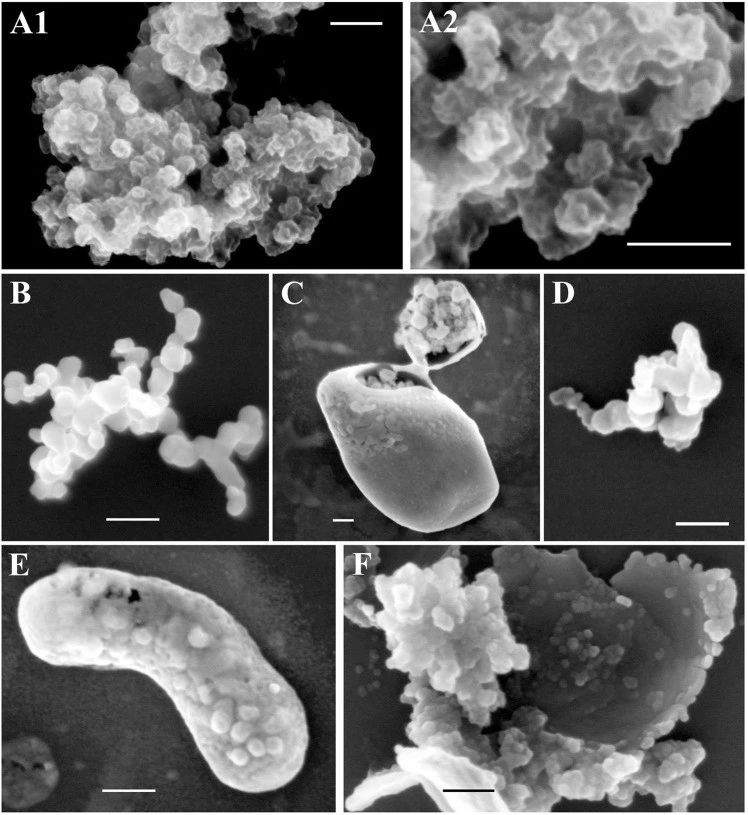
图6.聚焦离子束扫描电子显微镜(FIB-SEM)观察NNV颗粒的表面结构。
有趣的是,热变性NNV粒子的大聚集体被一种薄膜状结构(图6C、E、F)覆盖,用稍强的离子束照射很容易破坏。由于NNV颗粒纯度高,不存在形成薄膜状结构的污染。因此,我们推测这些薄结构可能是样品冷却后热变性突起与邻近颗粒随机再折叠形成的。
(本文已被浏览 10502 次) | | | | | |  文章分类 文章分类 | | | | |  相关文库: 相关文库: | | |
 相关资讯: 相关资讯: | | |
 文章链接 文章链接 | | | |
|